近日,由广西医科大学第一附属医院彭涛教授和马劼教授牵头的PLACES研究在Hepatobiliary Surgery and Nutrition重磅发表[1]。该研究主要聚焦于剩余肝脏组织(FLR)不足的肝细胞癌(HCC)人群,创新性地提出“手术做减法+药物做加法”的治疗模式,即门静脉结扎(PVL)联合阿帕替尼和卡瑞利珠单抗(“双艾”组合)后序贯肝切除术。研究结果显示,这一创新性疗法的疗效与安全性俱佳,相较于传统的联合肝脏分隔和门静脉结扎的二步肝切除术(ALPPS)的术后并发症发生率更低、治疗费用更低,生存获益更佳。中国医学论坛报现将该研究编译整理,邀您共阅。
研究背景
HCC是原发性肝癌的主要类型,肝切除术是延长生存的关键手段。然而,部分肿瘤较大、多发或靠近重要血管结构者,可能因FLR不足而无法进行根治性切除。联合肝脏分隔和门静脉结扎的二步肝切除术(ALPPS)是该类患者的重要治疗手段,但其伴随着术后并发症发生率高、死亡率高的局限性[2-3]。
阿帕替尼一种小分子酪氨酸激酶抑制剂(TKI),卡瑞利珠单抗是一种针对PD-1的免疫检查点抑制剂(ICI)。RESCUE和CARES-310研究显示两者联用在晚期HCC的一、二线治疗中均取得了积极的结果[4-5]。尤其是在CARES-310研究中,“双艾”组合一线治疗晚期HCC患者取得了长达23.8个月的中位总生存期(mOS),中位起效时间(TTR)仅为 1.9 个月,客观缓解率(ORR)高达 26.8%[5]。此外,对于不可手术切除的中晚期HCC,“双艾”组合也有广阔的应用前景。CARES-005研究显示,TACE联合“双艾”组合相较于单纯TACE治疗,可显著延长患者的无进展生存期(PFS,10.8 m vs 3.2 m,HR=0.34,P<0.0001),降低疾病进展或死亡风险达66%[6]。
因此,在现有手术技术面临局限性的情况下,研究团队创新性地对手术治疗做减法,使用PVL治疗,同时联合在晚期HCC、中晚期不可切除HCC中疗效和安全性均表现良好的“双艾”组合药物治疗,评估这种联合治疗手段后序贯肝切除术在FLR不足HCC患者中的疗效与安全性,同时与接受传统ALPPS治疗的患者比较短期手术结局和长期预后。
研究方法
本项单臂、前瞻性II期临床研究共纳入30例FLR不足的HCC患者,先接受PVL治疗,随后接受“双艾”组合治疗,直至达到II期肝切除术标准。肝切除术后,继续使用“双艾”组合进行为期一年的辅助治疗。
本研究的主要终点为1年无事件生存(EFS)率,次要终点为ORR、II期肝切除术完成率、总生存期(OS)和安全性数据。同时通过倾向性评分匹配(PSM),将本研究的入组患者(PLACES组)与同一中心既往接受ALPPS治疗的患者(ALPPS组)进行短期手术结局和长期预后比较。
研究结果
01
肿瘤反应与II期肝切除术结局
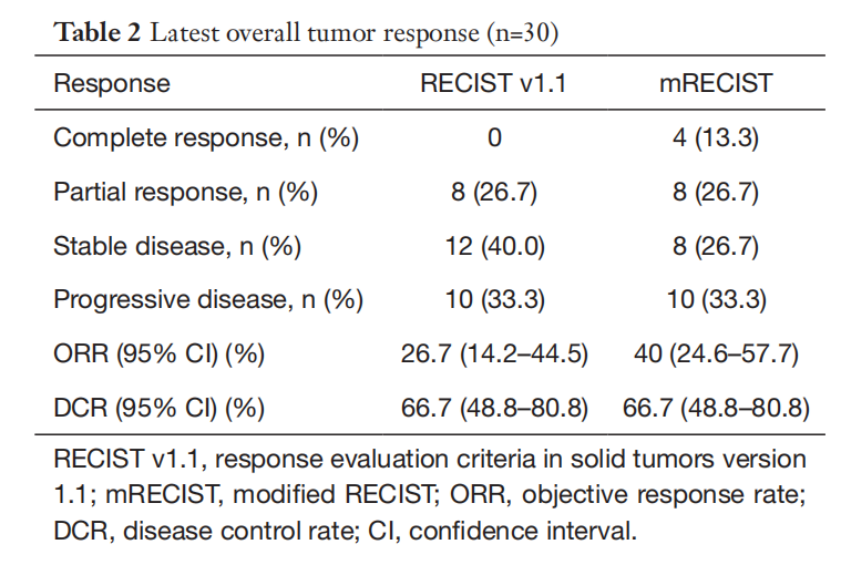
结果显示,主要终点1年EFS率达到63.3%(95%CI : 48.2%-83.1%)。肿瘤反应评估见图1。其中,根据mRECIST标准评估的ORR为40% (95% CI 24.6%-57.7%)。与疾病进展(PD)患者相比一级配资世界门户,达到完全缓解(CR)或部分缓解(PR)的患者表现出更好的OS(未达到vs 17.6 m,P=0.046,RECIST v1.1标准; P=0.048, mRECIST标准)。
图1 肿瘤反应评估结果
76.7%(23/30)的患者在PVL联合“双艾”组合治疗后达到了足够的FLR,66.7%(20/30)的患者完成了II期肝切除术,25%(5/20)的II期肝切除术患者达到了病理完全缓解(pCR)。成功完成II期肝切除术的患者表现出更优的OS(未达到vs 15.1 m,P<0.001)和EFS(无事件生存期,未达到 vs 9.6 m,P<0.001)。
02
安全性数据
PVL术后,常见的不良反应(>50%)为低白蛋白血症、手术切口疼痛、贫血等。“双艾”组合转化治疗期间,常见的不良反应为低白蛋白血症和谷草转氨酶(AST)升高。II期肝切除术后,常见的不良反应为低白蛋白血症、AST升高、谷丙转氨酶(ALT)升高等。“双艾”组合术后辅助治疗期间,常见的不良反应为低白蛋白血症和皮疹。上述不良反应主要为1-2级,整体安全可控。
03
PLACES组与ALPPS组的手术结局比较
本研究共纳入76例同一中心既往接受ALPPS治疗的患者。经1:1匹配后,最终选取了25名来自PLACES组和25名来自ALPPS组的患者,两组之间的临床特征总体相似。
结果表明,无论是否进行PSM,PLACES组均较ALPPS组具有更高的I期微创手术比例(P<0.001)和更低的I期术后并发症发生率(P<0.001)。同时,住院费用(84,976.6元 vs 144,149.1元,P<0.001)和总治疗费用(120,634.4元 vs 144,149.1元,P=0.02)也更低。进行PSM后,ALPPS组和PLACES组的II期肝切除术完成率相似,分别为76%和68%,但PLACES组的残肝体积增长量更高(242.9 ml vs. 180.4 ml,P=0.04)。
04
PLACES组与ALPPS组的生存结局比较
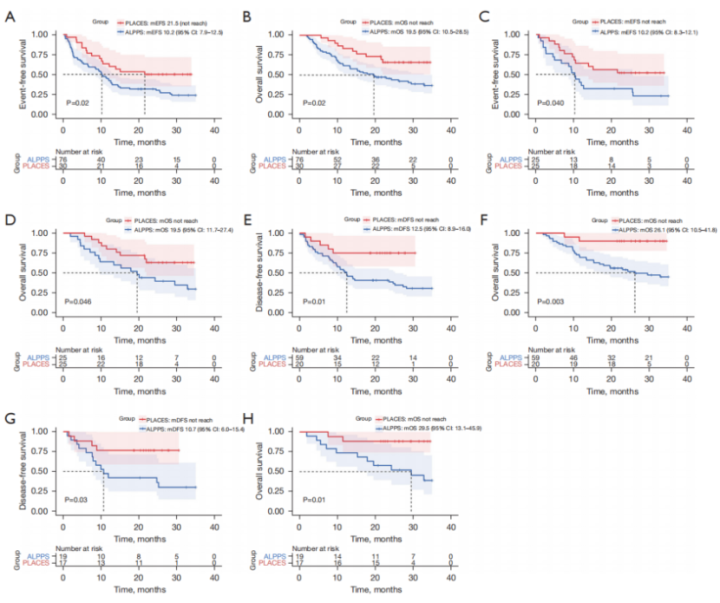
ALPPS组的1年EFS率为43.4%(95% CI 33.6%-56.1%),而PLACES组为63.3%(95%CI 48.2%-83.1%)。两组的生存分析结果见图2。结果显示,在PSM前,PLACES组的EFS(21.5 m vs 10.2 m, P=0.02)和OS(未达到 vs 19.5 m,P=0.02)均较ALPPS组更优(图2A、B)。经PSM后,趋势不变(图2C、D)。对于完成II期肝切除术的患者,在PSM前,PLACES组的DFS(无病生存期,未达到 vs 12.5 m,P=0.01)和OS(未达到 vs 26.1 m)均较ALPPS组更优(图2E、F)。经PSM后,趋势不变(图2G、H)。
图2 PLACES与ALPPS组的生存分析
(A,B:PSM前的OS和EFS Kaplan-Meier曲线;C,D:PSM后的OS和EFS Kaplan-Meier曲线;E,F:完成II期肝切除术者的PSM前的OS和DFS Kaplan-Meier曲线;G,H:完成II期肝切除术者的PSM后的OS和DFS Kaplan-Meier曲线)
研究结论
PVL联合“双艾”组合后序贯肝切除术的有效性和安全性良好,有望成为FLR不足HCC的治疗新选择。
临床实践案例分享
广西医科大学第一附属医院肝胆外科于Pharmacogenomics and Personalized Medicin发表的一例巨块型 HCC 合并完全性内脏逆位(SIT)病例,显示了PVL联合“双艾”组合后序贯肝切除术在真实世界应用的有效性和安全性[7]。
该患者诊断为BCLC B 期/CNLC Ⅱb 期 HCC,肝脏肿瘤负荷大(71 mm × 55 mm × 56 mm),FLR/标准肝体积仅37.4%,行肝切除术可能导致术后肝功能衰竭及相关并发症。同时,患者的胸腹部脏器完全倒置,俗称“镜像人”,手术难度巨大。经治疗团队评估,患者先行PVL联合“双艾”组合治疗,2个月后即达到II期手术条件,顺利完成了根治性切除术,提示PVL 序贯“双艾”组合的治疗策略有望成为 HCC 转化治疗的新选择。
小结
从研究数据来看,FLR不足的HCC患者在接受PVL联合“双艾”组合治疗后,肿瘤治疗影响应和II期肝切除术完成率良好。其中ORR达到40%,约2/3的患者完成了II期肝切除术,1/4的II期肝切除术患者实现了pCR。此外,在PLACES组中,接近2/3的患者在未来一年内未发生因疾病进展而出现局部或远处复发、任何原因导致的死亡等事件,且整体安全良好。
与当前的ALPPS治疗相比,PVL联合“双艾”组合治疗具有更低的术后并发症、更低的治疗费用和更好的生存获益,提示在国产原研药物(“双艾”组合)的保障下,通过对外科手术做减法,药物治疗做加法的新思路,有望在减轻患者经济负担的同时一级配资世界门户,为患者带来更多的治疗获益。而既往发表的该治疗策略应用于巨块型 HCC 合并SIT的病例报道也进一步体现了其在临床实践中应用的可行性和有效性。目前,关于该治疗策略的全国多中心研究也正在进行中,相信随着未来更多临床研究结果的发表和实践经验的积累,这种创新性的治疗模式将成为改变FLR不足的HCC治疗格局的重要手段。
新宝配资提示:文章来自网络,不代表本站观点。